 شرکت در آزمون آنلاین
شیمی 3
-
سری الکتروشیمیایی و پتانسیلهای کاهشی استاندارد
| آزمون شماره 5029
شرکت در آزمون آنلاین
شیمی 3
-
سری الکتروشیمیایی و پتانسیلهای کاهشی استاندارد
| آزمون شماره 5029
با توجه به واکنش زیر که در یک سلول گالوانی رخ میدهد، کدام مطلب نادرست است؟ $({E^0}(A{g^ + }_/Ag) = {0_/}8V)$ $A(s) + 2A{g^ + }(aq) \to {A^{2 + }}(aq) + 2Ag(s)$
با توجه به واکنشهای زیر عبارت کدام گزینه درست است؟ ${N_2}(g) + {O_2}(g) \to 2NO(g)$ (الف $C{l_2}(g) + 2KI(aq) \to {I_2}(s) + 2KCl(aq)$ (ب ${N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g)$ (ج
با توجه به شکل زیر، همۀ عبارتها درست هستند، بهجز ..........
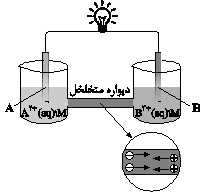
در مقایسه دو سلول گالوانی مختلف (روی - مس) و (مس - نقره) چه تعداد از عبارتهای زیر درست خواهد بود؟
الف) جهت حرکت الکترون در هر دو سلول عکس هم و به سمت گونهای با $E{}^\circ $ منفیتر است.
ب) تیغه مشترک در دو سلول، نقش متفاوتی جهت کاهش یا افزایش جرم خود خواهد داشت.
پ) گونه اکسنده در هر دو سلول یکسان اما گونه کاهنده متفاوت خواهد بود.
ت) افزایش غلظت کاتیونهای فلز مشترک در هر دو سلول، موجب افزایش اختلاف پتانسیل خواهد شد.
با توجه به مقادیر $E{}^\circ $ نیم سلولهای داده شده، کدام واکنش به صورتی که نوشته شده است، انجام میپذیرد؟
ولت $E{}^\circ \left( A{{l}^{۳+}}/Al \right)=-۱/۶۶$
ولت $~E{}^\circ \left( A{{g}^{+}}/Ag \right)=۰/۸$
ولت $E{}^\circ \left( M{{n}^{۲+}}/Mn \right)=-۱/۱۸$


