 شرکت در آزمون آنلاین
شیمی 2
-
مسائل آنتالپی (گرمای) واکنش
| آزمون شماره 3740
شرکت در آزمون آنلاین
شیمی 2
-
مسائل آنتالپی (گرمای) واکنش
| آزمون شماره 3740
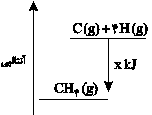
چنانچه برای تبدیل \[{0_/}8\] گرم متان به اتمهای گازی مجزا \[83\,kJ\] گرما مصرف شود، در نمودار زیر به جای x چه عددی باید قرار دهیم؟ (\[C{H_4} = 16\,g.mo{l^{ - 1}}\])
با توجه به واکنش گرماشیمی زیر: (واکنش موازنه شود.) $\begin{array}{*{20}{l}}{N{H_3}(g) + {O_2}(g) \to {N_2}(g) + {H_2}O(l)}&{\Delta H = - 1530\,kJ}\end{array}$ اگر واکنش در شرایط استاندارد انجام شده باشد و بر اثر انجام کامل آن ${61_/}2$ کیلوژول گرما آزاد شده باشد، حجم گازها در دما و فشار ثابت چه مقدار کاهش مییابد؟
با توجه به واکنشهای زیر، چه تعداد از عبارتهای زیر درست هستند؟ ${N_2}\,(g) + 3{H_2}\,(g) \to 2N{H_3}\,(g) + 92\,kJ$ ${N_2}{H_4}\,(g) + {H_2}\,(g) \to 2N{H_3}\,(g) + 183\,kJ$ الف) اگر حجمهای برابری از ${N_2}{H_4}$ و ${H_2}$ با هم واکنش دهند، گرمای واکنش، ضریبی از 183 کیلوژول خواهد بود. ب) واکنشدهندههای واکنش اول، 91 کیلوژول پایدارتر از واکنش دوم هستند. ج) گرمای واکنش اولی منفیتر از دوم است؛ بنابراین سطح انرژی فراوردۀ واکنش دوم پایینتر است. د) در واکنش اول، اگر تعداد مول ${H_2}$، سه برابر تعداد مول ${N_2}$ باشد، همواره$92\,kJ$ گرما آزاد خواهد شد.
یک سماور برقی در هر ثانیه ۱۰۰ ژول گرما تولید میکند. چنانچه ۰/۲ لیتر آب ۱۵ºC را در این سماور بریزیم چند دقیقه زمان لازم است تا در فشار یک اتمسفر به نقطه جوش برسد؟
($۱\, {g\over ml} , C_{H_۲O} =۴/۲ \,{J\over g^{\circ}C}$$\text{چگالی}\ \text{آب}=$ )
واکنشهای زیر را در نظر بگیرید:
$۱)~~{{N}_{۲}}\left( g \right)~+~{{O}_{۲}}\left( g \right)~~~\to ~~۲NO\left( g \right)~~~~~~~~~~~~~~~~~~~~~~~~~,\text{}~~~~\Delta {{H}_{۱}}=۹۰KJ$
$۲)~~N{{O}_{۲}}\left( g \right)~~\to ~~NO\left( g \right)+\frac{۱}{۲}{{O}_{۲}}\left( g \right)~~~~~~~~~~~~~~~~~~~~~~~~\text{}~~,\text{}~~~\Delta {{H}_{۲}}=-۷۰KJ$
اگر در واکنش: $۲N{{O}_{۲}}\left( g \right)\to{{N}_{۲}}\left( g \right)~+~۲{{O}_{۲}}\left( g \right)$ مقدار گرمای مبادله شده برابر $۱۳۸۰kJ$ باشد و $۲۶۲/۲$ گرم گاز اکسیژن ${{O}_{۲}}$ در این فرایند تولید شده باشد، بازده درصدی واکنش کدام است؟ $\left( O=۱۶~\text{}g.mo{{l}^{-۱}} \right)$


