 شرکت در آزمون آنلاین
شیمی 3
-
مسائل درجه یونش اسیدها
| آزمون شماره 3842
شرکت در آزمون آنلاین
شیمی 3
-
مسائل درجه یونش اسیدها
| آزمون شماره 3842
برای تهیه محلولی از هیدروفلوئوریک اسید (HF) با درصد یونش \[{2_/}5\]، به طوری که غلظت یون هیدروکسید در آن برابر \[{10^{ - {{10}_/}3}}\] باشد، چند گرم HF را باید به 100 لیتر آب اضافه کنیم؟ \[(\log 2 = {0_/}3)(H = 1\,\,,\,\,F = 19:g.mo{l^{ - 1}})\]
غلظت یون هیدرونیوم در محلولی از هیدروفلوئوریک اسید که از حل شدن 4 گرم HF در $200mL$ آب بهدست آمده است، چند مول بر لیتر است؟ ($\user1{\% }{2_/}5$ از مولكولهاي HF یونیده شدهاند.) $(H = 1\,\,,\,\,F = 19\,:g.mo{l^{ - 1}})$
اگر ثابت یونش یک اسید تک پروتوندار ${4_{/\,}}5 \times {10^{ - 4}}$ مول بر لیتر باشد، درصد یونش محلول 2 مولار آن در آب کدام است؟
با توجه به شکل زیر که غلظت اجزای حاصل از یونش اسید HA را نشان میدهد، درصد یونش اسید تقریباً کدام است؟
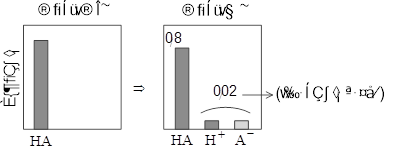
چنانچه درصد یونش اسید ضعیف HA در محلول \[{0_/}04\] مولار آن برابر 25% باشد، ثابت یونش این اسید به تقریب کدام است؟


