 شرکت در آزمون آنلاین
شیمی 3
-
مفاهیم کلی سلول های گالوانی
| آزمون شماره 3366
شرکت در آزمون آنلاین
شیمی 3
-
مفاهیم کلی سلول های گالوانی
| آزمون شماره 3366
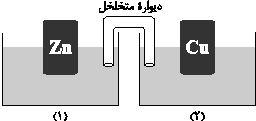
در شکل زیر، با اضافه کردن چند مورد میتوان از جریان تولیدشده استفاده کرد؟
الف) یک سیم ارتباطی بین دو محلول
ب) نمک $CuS{O_4}$ به ظرف (2)
ج) اضافه کردن اسید به محلول (2)
د) نمک $ZnS{O_4}$ به ظرف شمارۀ (1)
ﻫ) اضافه کردن سیم ارتباطی میان دو تیغه و مصرفکننده (لامپ)
و) جایگزین کردن سیم بهجای دیوارۀ متخلخل
چه تعداد از عبارتهای زیر در مورد سلولهای گالوانی درست است؟ الف) سلول گالوانی، دستگاهی است که میتواند بر اساس قدرت کاهندگی فلزها انرژی الکتریکی تولید کند. ب) در سلولهای گالوانی، جهت جریان الکترونها در مدار خارجی همواره از آند بهسمت کاتد است. ج) در سلولهای گالوانی، هر الکترود در محلولی متفاوت و شامل کاتیونهای فلزی خود قرار دارد. د) در سلولهای گالوانی، همواره گونة اکسنده تیغة کاتد و گونة کاهندة تیغة آند است.
در محلولی به حجم یک لیتر از مس (II) سولفات با غلظت مولی $۰/۰۵\frac{mol}{L}$ تیغهای از فلز روی قرار میدهیم. اگر پس از ۴۰ دقیقه محلول به طور کامل بیرنگ شود، چند مورد از مطلب زیر درست خواهد بود؟ $\left(Cu=۶۴,\ Zn=۶۵:g.{mol}^{-۱}\right)$
الف) ۳/۲ گرم مس آزاد میشود.
ب) علت بیرنگ شدن محلول، تبدیل مس (II) سولفات به روی سولفات است.
پ) سرعت متوسط مصرف مس (II) سولفات برابر $۷/۵\times{۱۰}^{-۲}mol.h^{-۱} $است.
ت) دمای مخلوط واکنش پس از ۴۰ دقیقه کاهش یافته است.
در واکنش اکسایش - کاهش زیر، مقداری آلومینیوم را به $۲۵۰$ میلی لیتر محلول $۲/۴$ مولار مس ($II$) سولفات میافزاییم. اگر واکنش در یک دقیقه و بیست ثانیه به طور کامل انجام شود، سرعت متوسط واکنش بر حسب مول برثانیه کدام بوده و تعداد مول الکترون مبادله شده چند است؟ (گزینه ها را از راست به چپ بخوانید، واکنش موازنه شده نیست)
$Al\left( s \right)+CuS{{O}_{۴}}\left( aq \right)\to Cu\left( s \right)+A{{l}_{۲}}{{\left( S{{O}_{۴}} \right)}_{۳}}\left( aq \right)$
بر روی ۶ گرم مخلوط پودر فلز روی و مس، مقدار اضافی محلول $HCl$ میریزیم. بعد از انجام همهی واکنشهای خود به خودی، پودر جامد باقیمانده در ته ظرف را بعد از خشک نمودن با ترازو وزن میکنیم. در صورتی که جرم پودر جامد باقیمانده ۴/۵ گرم باشد، درصد جرمی روی در مخلوط اولیه کدام است؟
$\left\{\begin{matrix} E^{\circ}\, Zn^{۲+}/Zn=\, -۰/۷۶\, V\\ E^{\circ}\, Cu^{۲+}/Cu=\, ۰/۳۴\, V \end{matrix}\right.$


